
ДНК-диагностика наследственных заболеваний молочного скота
Интенсивное использование мирового породного генофонда крупного рогатого скота и биотехнологий репродукции (искусственное осеменение, трансплантация эмбрионов) позволили значительно повысить генетический потенциал продуктивности животных.
Однако широкое использование ограниченного контингента производителей привело к тому, что в разных странах, в том числе и РФ, фиксировалось рождение телят с различными аномалиями, которые, как показала ДНК-диагностика, имели наследственную основу, обусловленную мутациями генов.
Совершенно не случайно в странах с развитым животноводством действуют национальные программы генетического мониторинга, включающие в качестве обязательного элемента генетическое обследование животных на присутствие наследственных заболеваний. В России подобные исследования предусмотрены рядом законодательно-правовых документов. Однако в силу разных причин молекулярно-генетическая диагностика не получила широкого распространения в животноводстве нашей страны и отсутствует на Ставрополье. Впервые получены и проанализированы результаты скрининговых исследований на носительство мутаций, детерминирующих развитие наследственных заболеваний молочного скота, разводимого в племенных хозяйствах Ставропольского края. Установлено присутствие генетических мутаций: CV – комплексный порок позвоночника (CVM), BL – дефицит лейкоцитарной адгезии (BLAD), DP – дефицит уридинмонофосфатсинтетазы (DUMPS) у коров с функциональными нарушениями воспроизводства, с частотой встречаемости от 4,5 до 6,3 %. Даны обозначения и описание действия мутантных аллелей, симптомы их воздействия на организм. Приводится схема проведения скрининговых работ для своевременного выявления и элиминации животных-носителей генетического груза.

В последние годы особую актуальность приобрела проблема распространения вредных летальных рецессивных мутаций практически во всех породах молочного скота и, к сожалению, с регулярной повторяемостью появления новых дефектов.
В крупнейшей базе данных мира, содержащей информацию о наследственных дефектах 186 видов животных, – ОМIА – каталог (onlinemendelian inheritance in animals) Университета Сиднея дано фенотипическое описание 398 наследственных аномалий крупного рогатого скота, в том числе 145 обусловленных изменениями в одном локусе, из которых 79 наследственных дефектов описано на молекулярном уровне.
К наиболее часто встречаемым генетическим дефектам молочного скота, приносящим значительный экономический ущерб, относятся: комплексный порок позвоночника – CVM, дефицит адгезии лейкоцитов – BLAD, дефицит уридинмонофосфатсинтетазы – DUMPS.
Комплексный порок позвоночника – CVM
Причиной этой наследственной аномалии является точечная G/T мутация гена SLC35A3 в позиции 559 из семейства Homobox-генов.
Результаты мониторинга свидетельствуют о том, что доля быков – скрытых носителей CVM на племпредприятиях России составляет 3,7 %, то есть в среднем 1 из 27 производителей, используемых в системе искусственного осеменения, является скрытым носителем этого наследственного дефекта.
Синдром СVM сопровождается многочисленными уродствами скелета новорожденных телят: сросшиеся и деформированные позвонки, неправильное развитие позвоночных дисков, сколиоз, кифоз, расщепление позвоночника, известны случаи полного отсутствия поясничных, крестцовых и хвостовых позвонков. Как правило, уродства телят сопровождаются низкой живой массой, а также аномалиями внутренних органов.
Дефицит лейкоцитарной адгезии – BLAD
Молекулярной основой ВLAD является точечная мутация в кодирующей части гена CD18, она связана с заменой нуклеотида аденина на гуанин в 383 позиции ДНК, вызывающая в свою очередь замещение в положении 128 аспарагиновой кислоты на глицин, имеющая аутосомнорецессивный характер наследования.
Носительство мутации установлено в 1992 г. Мутация быстро распространилась в голштинской породе из-за доминирования потомков быка-производителя USA000001667366 Carlin-M Ivanhoe Bell (К. М. Белла Айвенго Бемм), 1974 г. р., а также быков-носителей деда, отца, братьев, сестер, многочисленных сыновей, внуков и других родственных групп.
Синдром BLAD сопровождается резким падением функциональной активности фагоцитоза, эндотелиальной адгезии, невозможностью выхода лейкоцитов за пределы кровеносного русла и неспособностью выполнять защитную функцию, в результате возникает иммунодефицитное состояние, при котором животное погибает от любой инфекции в ранний период онтогенеза (2–4 месяца).
Уридинмонофосфататсинтетаза – DUMPS
Установлено, что заболевание обусловлено точечной мутацией (С→Т) в 405 кодоне. Это приводит к образованию преждевременного стоп-кодона и усеченной с-терминальной субъединицы протеина. Точка мутации обозначена как R405Stop. Изучен молекулярный механизм мутации: у гетерозиготных животных вследствие точечной замены С→Т кодон 405 СGA, кодирующий аргинин, заменяется нонсенакодоном (Stop-codon) TGA.
Носительство этого скрытого генетически рецессивного заболевания было выявлено у быка-производителя USA000001308101 Sko kie Sensation Ned, 1957 г. р. Аутосомная рецессивная мутация DUMPS приводит к дефициту активности фермента уридинмонофосфатсинтетазы, который связан с воспроизводительной функцией животных и влияет на выживаемость потомства. Эта рецессивная мутация, обнаруженная у голштинского скота, вызывает у гомозигот раннюю эмбриональную смерть, в то время как гетерозиготы фенотипически нормальны, но с низкой (в два раза) активностью фермента в различных тканях.
Цель исследования – скрининг генетических аномалий купного рогатого скота разных пород молочного направления продуктивности.

Скрининговые исследования осуществлены на выборке молочных коров основных пород, разводимых в племенных хозяйствах Ставропольского края: черно-пестрая (СПК «Россия» Новоалександровского района, n=24; СПК КПЗ «Казьминское», n=35; СПК КПЗ им. Чапаева Кочубеевского района, n=36; СПК колхоз им. Ворошилова Труновского района, n=22), айрширская (СПК КПЗ «Кубань» Кочубеевского района, n=17), голштинская красно-пестрая (СПК колхоз им. Ворошилова Труновского района, n=10), голштинская (ООО СП «Чапаевское» Шпаковского района, n=37; ООО «Приволье» Красногвардейского района, n=22). Всего генотипировано 203 головы.
Материалом для исследований служила ДНК животных, выделенная из крови с применением стандартных наборов (ООО «Изоген», г. Москва).
Точечные мутации CVM и ВLAD выявлялись методом полимеразной цепной реакции в реальном времени (ПЦР-РВ) с использованием набора реагентов (CVM – ВLAD), разработанного компанией ЗАО «Синтол», позволяющего одновременно диагностировать обе аномалии.
При диагностировании ВLAD для кодирующей части гена CD18 использовались аллельспецифические наборы олигонуклеотидов в положениях 383A→G, а для диагностики CVM – точечная G→T мутация гена SLC35A3 в позиции 559. Для определения CT и CV аллелей использовались 2 канала – Green и Yellow: нормальный CT аллель давал рост сигнала по каналу Green, детектируемый флуорофором FAM, а мутантный аллель CV – по каналу Yellow, детектируемый флуорофором R6G.
Что касается TL и BL аллелей, то для их определения использовались также 2 канала – Orange и Red. Нормальный TL аллель давал рост сигнала по каналу Orange, детектируемый флуорофором ROX, а мутантный аллель BL – по каналу Red, детектируемый флуорофором Cy5.
Результаты интерпретировались на основании наличия или отсутствия кривой флуоресценции. При оптимальном количестве копий ДНК кривая хорошо просматривалась начиная с 20–25 цикла до окончания 45 циклов амплификации. Так как использование кривых не требует никаких дополнительных манипуляций с пробирками, то интерпретация полученных данных осуществлялась автоматически.

При идентификации мутации DUMPS использовался метод гель-электрофореза с визуализацией продуктов ПЦР-ПДРФ под ультрафиолетовым светом. Амплификация проводилась с помощью двух синтезированных олигонуклеотидных праймеров следующего состава: UMPS L 5`GCAAATGGCTGAAGA-ACATTCTG-3` UMPS R 5`GCTTCTA-ACTGAACTCCTCGAGT-3`. Режим амплификации: «горячий старт»
(94 °С – 4 мин); 35 циклов ПЦР: денатурация (94 °С – 1 мин); отжиг праймеров (62 °С – 1 мин); элонгация (72 °С – 1 мин). В амплифицируемом участке ДНК находились два сайта узнавания для эндонуклеазы Ava1.
Рестрикция ДНК производилась с помощью рестриктаз, относящихся к группе бактериальных эндонуклеаз. В случае разрезания продукта амплификации рестриктазой на фрагменты 53, 36, 19 п. н. образец диагностировался как гомозиготный TD/TD DUMPS-генотип (здоровое животное), если – 89, 53, 36 п. н. – как гетерозиготный
TD/DP DUMPS-генотип (скрытый носитель мутаций), если – 89, 19 п. н. – как гомозиготный DP/DP DUMPS-генотип (больное животное).
Исходя из того, что существует вероятность присутствия носителей генетических дефектов среди коров с нарушениями функционального воспроизводства (аборты, рождение мертвых телят, гинекологические заболевания), то особое внимание для предотвращения распространения скрытых мутаций должно уделяться этой группе животных.
На основании анализа материалов первичного зооветеринарного учета, журналов осеменений и отелов, регистрации приплода была осуществлена выборка коров с нарушениями воспроизводительных функций.
В результате скрининговых работ по выявлению генетических мутаций в локусах генов ВLAD, CVM, DUMPS установлено, что в выборе коров с нарушениями функций воспроизводства айрширской (СПК КПЗ «Кубань»), чернопестрой (СХ ПК «Россия», СПК КПЗ им. Чапаева) пород мутантные аллели (BL, CV, DP) отсутствовали (табл. 1).
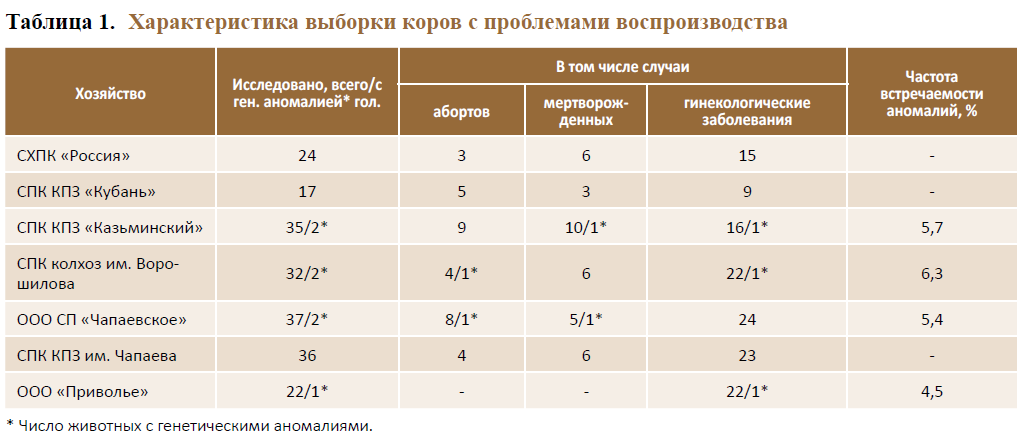
СП «Чапаевское») установлено присутствие генетических аномалий: BL в локусе гена ВLAD у абортированной коровы, DP в локусе гена DUMPS – в группе коров, родивших мертвых телят.
В выборке коров этой же породы (СПК КПЗ «Казьминский») мутантная аллель BL гена ВLAD присутствовала среди коров, родивших мертвых телят, а также с нарушениями воспроизводительного цикла.
В выборке коров ООО «Приволье» мутантная аллель DP присутствовала в группе животных с гинекологическими заболеваниями.
В выборке коров черно-пестрой породы (СПК им. Ворошилова) выявлены носители генетических аномалий: CV в локусе гена CVM у абортированной коровы черно-пестрой породы, DP в локусе гена DUMPS – среди коров этой же породы с гинекологическими заболеваниями.
Выявленная ситуация свидетельствует об актуальности скрининга стад голштинского и голштинизированного скота, разводимого в хозяйствах Ставропольского края.
Для определения причин появления мутантных аллелей в стадах молочного скота необходим генеалогический анализ выявления путей передачи генетического груза.
Одним из основных методических подходов контроля распространения мутаций, обусловливающих наследственные дефекты и постепенное их элиминирование из племенных стад, является системная организация в проведении скрининговых работ, которая позволит, прежде всего, оценить генетическую ситуацию в каждом хозяйстве, провести целенаправленный подбор родительских пар для получения потомства, лишённого генетических дефектов, установить причину нарушений функции воспроизводства коров. Такой подход позволит осуществлять идентификацию генетических дефектов в течение очень короткого периода времени, определить статус животных на носительство наследственных аномалий, получить информацию о их распространении в стадах.
С учетом количества животных, подлежащих ДНК-диагностике, для каждого хозяйства определяется оптимальное поголовье для проведения скрининговых работ по выявлению генетических дефектов (табл. 2).
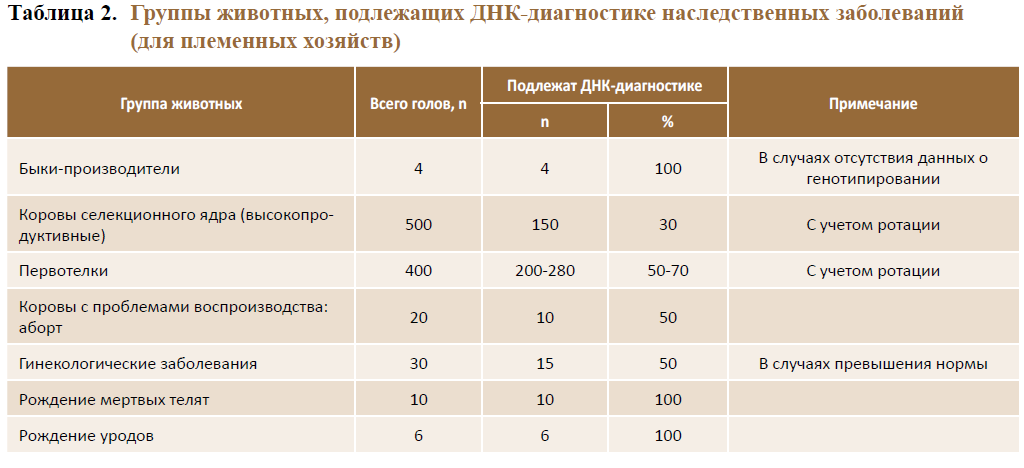
Системный скрининг обеспечивает: высокую информативность, возможность использования любого исходного биоматериала (кровь, сперма, кожа) для проведения генодиагностики в раннем возрасте независимо от пола и физиологического состояния животных, а также длительность хранения образцов при низких температурах; а высокая производительность метода (50 и более голов в день) – минимальную стоимость работ при ее проведении.
Благодаря фундаментальным достижениям в биотехнологии генетические факторы в настоящее время используются в решении вопросов не только при прогнозе селекционной перспективности сельскохозяйственных животных, но и при оценке их генетического благополучия, являющегося одним из основных факторов экономической составляющей животноводческой отрасли.
Сложность ситуации заключается в том, что основная часть врожденных дефектов не имеет клинического проявления в течение всей жизни животного, кроме того, зачастую носителями наследственного дефекта являются высокопродуктивные и, как правило, широко используемые в селекционном процессе животные. В этой связи значительная роль отводится организации и проведению скрининговых работ по выявлению генетически наследуемых заболеваний.
Одним из ключевых элементов по выявлению наследственных аномалий является организация и проведение системного генетического скрининга. Что дает возможность определить статус племенных животных на носительство наследственных дефектов, контроля их распространения, разработать программы, направленные на их элиминацию как в стадах, так и в хозяйствах в целом.
Проведение ДНК-мониторинга показало отсутствие генетических аномалий у племенных коров айрширской породы, имеющих проблемы с воспроизводством, и наличие генетических мутаций CV (комплексный порок позвоночника, CVM), BL (дефицит лейкоцитарной адгезии, BLAD), дефицит уридинмонофосфатсинтетазы (DUMPS) у коров черно-пестрой и голштинской пород с функциональными нарушениями воспроизводства, с частотой встречаемости от 4,5 до 6,3 %.
Системная организация скрининговых работ позволяет осуществлять идентификацию летальных генетических дефектов в воспроизводительной части стада (быки-производители, коровы селекционного ядра, первотелки) до случной компании. Такой подход обеспечивает участие в селекционном процессе только тех животных, которые не имеют генетического груза.
Трухачев Владимир Иванович, Академик РАН, доктор с.-х. наук, профессор;
Злыднев Николай Захарович, доктор с.-х. наук, профессор;
Олейник Сергей Александрович, доктор с.-х., профессор,
ФГБОУ ВО «Ставропольский ГАУ»
Селионова Марина Ивановна, доктор биолог. наук, профессор РАН;
Чижова Людмила Николаевна, доктор с.-х. наук, профессор;
Бобрышова Галина Тимофеевна, кандидат с.-х. наук, доцент,
ФГБНУ «Всероссийский НИИ овцеводства и козоводства» f
Оцените эту статью!
Аргентинская технология производства инокулянтов БИОНА
© КОПИРАЙТ, 2013-2019. Все материалы на сайте защищены Законом об авторском праве. Использование материалов с сайта возможно только с письменного согласия Администрации сайта. По вопросам разрешений на публикации и рекламы обращайтесь +7-905-395-28-88. Мобильное приложение доступно на iTunes и AndroidMarket.


 Архив
Архив
